Пространство
в цилиндре под поршнем объемом V1 = 1,50 м3 занимает смесь азота и насыщенных водяных
паров при температуре T = 301 K. Масса смеси m = 300 г. Какая масса
паров сконденсируется при изотермическом уменьшении объема в n раз (n = 2)? Каково было
давление p1 смеси до сжатия?
Решение.
M1 – молярная масса водяного пара. Найдем массу
сконцентрированного пара.
Теперь
найдем массу азота в цилиндре.
Парциальное
давление азота до сжатия найдем их уравнения Клапейрона-Менделеева.
M2 – молярная масса азота. Давление смеси до сжатия p = pн + p1 ≈ 19,2 кПа.
Ответ:
p = 19,2 кПа.
Источник: Физика. Полный курс подготовки к ЦТ. Под общей редакцией проф. В.А. Яковенко.


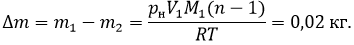


Комментариев нет:
Отправить комментарий